Del denne artikkelen:
Facebook
Twitter
LinkedIn
NB! Denne utredningen er mer enn 5 år gammel.
Norske leger og annet helsepersonell har gjennom bivirkningsmeldinger og henvendelser til RELIS bidratt til å avdekke at pregabalin har et betydelig misbruks- og avhengighetspotensiale som ikke var kjent da legemidlet ble markedsført (1). Statens legemiddelverk har fulgt opp signalene, og har etter en grundig gjennomgang av innrapporterte bivirkningsmeldinger og publisert litteratur besluttet å flytte pregabalin (Lyrica) fra reseptgruppe C til reseptgruppe B. Endringen trådde i kraft 1. juni 2018 (2). Hensikten med endring av reseptgruppestatus er å tydeliggjøre risikoen for misbruk og avhengighet både for forskriver og pasient (2, 3).
Høyt forbruk hos enkelte brukere
Lyrica fikk markedsføringstillatelse i Norge i 2004. Preparatet er godkjent for bruk ved nevropatisk smerte, epilepsi og generalisert angstlidelse, men brukes også en del off-label ved andre indikasjoner (1, 2). Maksimalt anbefalte døgndose er 600 mg (4). Forbruket har økt opp gjennom årene, og tall fra Reseptregisteret viser at om lag 23 500 norske pasienter fikk forskrevet og utlevert pregabalin i 2017 (figur 1) (5). Den forbigående nedgangen etter 2007 kan skyldes endring i refusjonsreglene (3). Omsetningen målt i form av definerte døgndoser (DDD, 300 mg/døgn for pregabalin) gikk ikke tilsvarende ned i denne perioden, noe som må skyldes økt forbruk blant brukerne som helhet eller i enkelte subgrupper. Flere senere publikasjoner har indikert bruk av supraterapeutiske doser hos enkelte pasienter, noe skandinaviske forbruksdata bekrefter:
Norge (6):
Sverige (7):
Danmark (7):
Illegal omsetning er ikke medregnet i disse tallene.
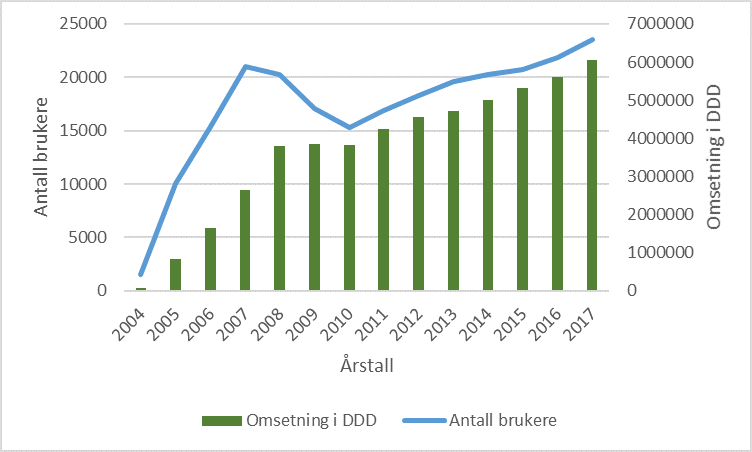 Figur 1: Utvikling av antall norske brukere av pregabalin og DDD (definerte døgndoser) fra preparatet kom på markedet i 2004 og frem til nå. Med brukere menes pasienter som har fått forskrevet og utlevert legemidlet. Tallene er hentet fra Reseptregisteret (5).
Figur 1: Utvikling av antall norske brukere av pregabalin og DDD (definerte døgndoser) fra preparatet kom på markedet i 2004 og frem til nå. Med brukere menes pasienter som har fått forskrevet og utlevert legemidlet. Tallene er hentet fra Reseptregisteret (5).
Signalgenerering og oppfølging av signalene
RELIS fikk allerede i 2005 det første signalet om at pregabalin kunne ha et misbruks- og avhengighetspotensial (8), og dette ble etterfulgt av flere titalls bivirkningsmeldinger med mistanke om eufori, misbruk, avhengighet, toleranseutvikling og/eller seponeringsreaksjoner ved bruk av pregabalin. Signalet i de norske rapportene ble etter hvert også styrket av rapporter fra andre land, og i 2010 ble preparatomtalen oppdatert med informasjon om at tilfeller på misbruk av pregabalin var registrert, at forsiktighet bør utvises hos pasienter med kjent rusmisbruk, samt at man bør overvåke for symptomer på misbruk hos pasienter som bruker pregabalin (1).
Ruseffekt
Det er i de siste årene også publisert flere studier og oversiktsartikler om temaet, som levner liten tvil om at pregabalin har et betydelig misbruks- og avhengighetspotensiale (7, 9, 10). Pasienter har beskrevet russymptomer blant annet i form av ”å være høy”, noen har sammenlignet det med ruseffekten de får av benzodiazepiner, amfetamin eller alkohol, og flere har angitt at de har brukt pregabalin for å potensere effekten av andre rusmidler. Det er rapportert om alternative administrasjonsmåter i form av injeksjon og sniffing, samt illegal omsetning av legemidlet. Preparatet er også omtalt i diverse internettforum, der erfaring med legemidlets ruseffekter deles (1, 3, 7-11).
Hvem er i risikogruppen?
De fleste rapportene og studiene viser misbruk av pregabalin hos pasienter med kjent rusmisbruk, og risikoen for misbruk synes dermed å være klart størst i denne brukergruppen (1, 7, 9, 10). Det foreligger også et fåtall rapporter om misbruk av pregabalin hos pasienter uten tidligere historikk på rusmisbruk (1). Forskrivere bør derfor være årvåkne for tegn til misbruk hos alle som bruker legemidlet, for eksempel dersom pasienten etterspør økende forskrivning. Det er vist toleranseutvikling for den euforiske effekten av pregabalin, og flere rapporter beskriver pasienter med selvinitierte doseøkninger til over 2000 mg daglig, og i noen tilfeller enda høyere (1, 7-11).
Ubehagelige seponeringsreaksjoner
Mange rapporter beskriver seponeringsreaksjoner etter bruk av pregabalin, og insidens og alvorlighetsgrad av reaksjonene synes å være doserelatert (4, 12). Det er blant annet rapportert om insomni, hodepine, kvalme, diaré, angst, influensasyndrom, nervøsitet, rastløshet, depresjon, smerte, kramper, hyperhidrose og svimmelhet. Noen pasienter har hatt behandlingskrevende seponeringsreaksjoner og behov for innleggelse på institusjon for nedtrapping og seponering. Enkelte rusmisbrukere har gitt uttrykk for at seponering av pregabalin har vært svært krevende (1, 12). For å redusere risiko for seponeringsreaksjoner er det i preparatomtalen anbefalt gradvis nedtrapping over minst en uke. (4) Seponeringsreaksjoner er også rapportert til tross for gradvis nedtrapping, både hos pasienter som har misbrukt pregabalin og etter vanlig terapeutisk bruk (1). Det er derfor grunn til å anbefale individuell nedtrappingsplan, med lengre nedtrappingstid jo lengre pasienten har brukt legemidlet (12).
Fare for misbruk avdekket av bivirkningsmeldinger
Da pregabalin kom på markedet tydet dokumentasjon som lå til grunn for markedsføringstillatelsen på lavt avhengighets- og misbrukspotensiale (11). Slike bivirkninger er imidlertid vanskelig å avdekke i kontrollerte studier utført på et begrenset antall og sterkt selekterte pasienter som følges nøye opp. Overvåkning etter markedsføring er derfor viktig. Ved hjelp av årvåkne helsepersonell som har meldt fra om sine mistanker om at preparatet ble misbrukt og førte til avhengighet har man altså avdekket at dette kan være et problem ved bruk av pregabalin, noe endringen av reseptgruppe understreker. Dette viser at det nytter å melde fra om mistenkte bivirkninger.
Meld bivirkninger!
Har du observert problemer med misbruk eller seponeringsvansker knyttet til legemidler eller andre alvorlige eller uventede bivirkninger? Da oppfordrer vi deg til å melde det som bivirkning til RELIS. For å kunne avdekke potensielt nye bivirkninger og identifisere risikofaktorer er vi avhengig av årvåkne leger som melder fra om sine observasjoner. Denne type bivirkninger er ikke alltid kjent når nye legemidler blir markedsført. Økt kunnskap om legemidlenes sikkerhetsprofil vil komme både deg som forskriver og dine pasienter til gode.
Utredningen er utarbeidet på grunnlag av tilgjengelig litteratur og ressurser på publiseringstidspunktet. Innholdet i utredningen oppdateres ikke etter publisering. Helsepersonell er selv ansvarlig for bruk av utredningens innhold i rådgivning eller pasientbehandling.