Del denne artikkelen:
Facebook
Twitter
LinkedIn
Vi har valgt å fokusere på de biologiske legemidlene som brukes ved dermatologiske, gastroenterologiske og/eller revmatologiske lidelser. Biologiske legemidler som kun brukes for eksempel ved multippel sklerose eller ulike kreftformer er derfor ikke tatt med i denne oversikten. Tabell 1 gir oversikt over inkluderte legemidler, samt overordnede råd om bruk av disse.
Tabell 1. Aktuelle biologiske legemidler og råd ved bruk under graviditet, ved amming samt ved bruk av far ved befruktning.
| Virkestoff | Handelsnavn | Bruk under graviditet | Bruk under amming | Bruk av far |
| TNF-alfa-hemmere | ||||
| Adalimumab | Humira | Ja | Ja | Ja |
| Certolizumab | Cimzia | Ja | Ja | Ja |
| Etanercept | Enbrel, Benepalia | Ja | Ja | Ja |
| Golimumab | Simponi | Ja | Ja | Ja |
| Infliksimab | Remicade, Inflectraa, Remsimaa | Ja | Ja | Ja |
| Interleukin-hemmere | ||||
| Anakinra | Kineret | Nei* | Etter vurdering** | Ja |
| Brodalumab | Kyntheum | Nei* | Etter vurdering** | Ja |
| Canakinumab | Ilaris | Nei* | Etter vurdering** | Ja |
| Guselkumab | Tremfya | Nei* | Etter vurdering** | Ja |
| Iksekizumab | Taltz | Nei* | Etter vurdering** | Ja |
| Sekukinumab | Cosentyx | Nei* | Etter vurdering** | Ja |
| Tocilizumab | RoActemra | Nei* | Etter vurdering** | Ja |
| Ustekinumab | Stelara | Nei* | Etter vurdering** | Ja |
| Øvrige | ||||
| Abatacept | Orencia | Nei* | Etter vurdering** | Ja |
| Belimumab | Benlysta | Nei* | Etter vurdering** | Ja |
| Rituksimab | MabThera, Rixathona | Nei* | Etter vurdering** | Ja |
| Vedolizumab | Entyvio | Nei* | Etter vurdering** | Ja |
a Biotilsvarende produkt
* Andre legemidler med mer dokumentasjon bør foretrekkes
** Forventet lav eksponering hos diebarn, men lite data
Blant biologiske legemidler er det mest erfaring med bruk av TNF-alfa-hemmere (1, 2). Disse har vært brukt i over 15 år, mens for biologiske legemidler som er kommet på markedet for mindre enn 5 år siden er det svært sparsomt med data på bruk hos gravide og ammende (1).
Det er utviklet biotilsvarende legemidler blant annet for TNF-alfa-hemmerne infliksimab og etanercept, men det foreligger lite data på bruk under graviditet og amming for disse. Flere kilder anbefaler derfor å velge originalpreparatet fremfor biotilsvarende TNF-alfa-hemmer under graviditet og amming (2, 3). RELIS har imidlertid tidligere uttalt at biotilsvarende etanercept kan benyttes på lik linje med originalt etanercept ved svangerskap og amming, fordi det ikke forventes større forskjell mellom originalpreparat og biotilsvarende legemiddel enn mellom ulike batcher av originalpreparatet (4).
Graviditet – BRUK HOS MOR
Avgjørelser om behandling av gravide kvinner med biologiske legemidler må skje på individuelt grunnlag hvor man vurderer fordelen ved behandlingen mot mulig risiko for barnet. I mange tilfeller kan også dårlig kontrollert sykdom hos den gravide kvinnen utgjøre en risiko for barnet (1, 5). Det er viktig med adekvat kontroll av sykdomsaktiviteten, og kvinnen bør ideelt være i remisjon ved starten av et svangerskap (1, 2, 5, 6).
Biologiske legemidler er helt eller delvis IgG molekyler. Figur 1 viser strukturene til TNF-alfa-hemmere. Fosterets eksponering for IgG er svært lav under organogenesen, og foregår kun ved passiv diffusjon. Alle biologiske legemidler som inneholder en funksjonell Fc-region blir aktivt transportert over placenta via føtale Fc-reseptorer fra og med begynnelsen av 2. trimester og i økende grad frem mot termin (1, 2, 6). Ved termin forventes serumkonsentrasjonen av disse legemidlene hos foster å være like høy eller høyere enn hos mor. (1, 6). Immunglobuliner har forlenget halveringstid i nyfødte og er målt i barnets blod i opptil 6 måneder etter fødselen (1).
På grunn av den lange halveringstiden til biologiske legemidler hos nyfødte, er levende, svekkede vaksiner frarådet i løpet av de første 6 levemånedene når mor har brukt et slikt legemiddel etter 22. svangerskapsuke (3, 6).
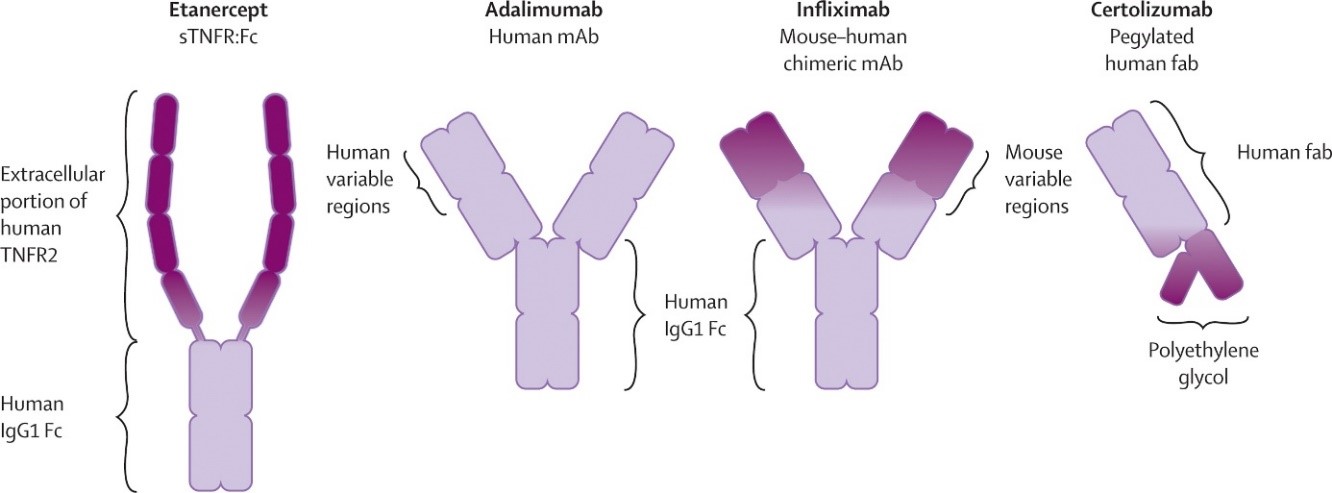
Figur 1. Strukturen til ulike TNF-alfa-hemmere. Figuren er hentet fra: Wallis RS. Tumour necrosis factor antagonists: structure, function, and tuberculosis risks. Lancet Infect Dis 2008; 8: 601–11 (referanse 7). Gjengitt med tillatelse fra forfatteren.
TNF-alfa-hemmere
Erfaringsgrunnlaget for eksponering for TNF-alfa-hemmere under graviditet er fortsatt begrenset, men er størst for infliksimab (over 1000 graviditeter), etterfulgt av adalimumab og etanercept (over 500 graviditeter), certolizumab (over 300 graviditeter) og golimumab (ca 50 graviditeter) (1, 2).
Det er ikke vist økt risiko for spontanabort, lav fødselsvekt, for tidlig fødsel eller misdannelser etter bruk av TNF-alfa-hemmere under graviditet (2, 6, 8). Det er imidlertid bekymringer knyttet til effekten av TNF-alfa-hemmere på utviklingen av immunsystemet hos fosteret og det nyfødte barnet. Det er sett enkelte tilfeller av forbigående neutropeni hos nyfødte der mødrene hadde brukt TNF-alfa-hemmer i svangerskapet (6).
Infliksimab, adalimumab og golimumab er hele IgG antistoffer som gjennomgår aktiv transport over placenta den siste halvdelen av svangerskapet. Etanercept er et fusjonert protein og transporteres i mindre grad enn humant IgG over placenta (10-20 %) (3). Certolizumab har ikke Fc-region, og overgang til fosteret antas å kun skje ved passiv diffusjon. (1, 3). Målinger har vist knapt detekterbare mengder av certolizumab hos barnet (<10 %) (2, 3).
Flere kilder viser til at europeiske legemiddelmyndigheter i januar 2018 godkjente certolizumab, som den eneste av TNF-alfa-hemmerne, for bruk i svangerskap og ved amming. (3, 9a). Retningslinjer trekker likevel ikke frem certolizumab spesielt som foretrukket blant TNF-alfa-hemmerne på nåværende tidspunkt. Dette kan tenkes å ha sammenheng med at det totale erfaringsgrunnlaget var begrenset da retningslinjene ble publisert.
Retningslinjer for behandling av gastroenterologiske og revmatologiske lidelser støtter nå i større grad enn før bruk av TNF-alfahemmere i første halvdel av graviditeten, (1, 6). Økt fokus på de negative effektene av ubehandlet sykdom kan også ha bidratt til denne utviklingen (2). Det er omdiskutert om TNF-alfa-hemmere med aktiv transport over placenta bør seponeres før 3. trimester, men retningslinjene åpner for bruk gjennom hele svangerskapet hvis det er et klinisk behov (1, 6).
Når det gjelder bruk av TNF-alfahemmere hos gravide kvinner med psoriasis, er erfaringsgrunnlaget mye mindre enn for de andre to sykdomsgruppene. Det er også i større grad usikkert hvilken risiko ubehandlet psoriasis har for fosteret (10, 11).
Interleukin-hemmere og øvrige biologiske legemidler
For biologiske legemidler unntatt TNF-alfa-hemmere finnes det kun et begrenset antall kjente eksponeringer under graviditet. På grunn av manglende erfaring kan man ikke vurdere eventuelle effekter på barnet, og det bør vurderes å bytte til legemidler der det er større erfaringsgrunnlag hos gravide (1, 2). Behandling med rituksimab i 2. og 3. trimester har vist forbigående redusert B-celledannelse og cytopeni hos nyfødte (1-3).
Graviditet – BRUK HOS FAR
Til nå er det ikke kjent at legemiddelbruk hos far i forbindelse med befruktning faktisk har gitt fosterskader eller andre uheldige effekter. Selv om datagrunnlaget generelt er begrenset, ser vi på paternell eksponering som en lite viktig faktor for fosterskader (12).
Basert på et svært begrenset erfaringsgrunnlag er det ikke holdepunkter for at eksponering for TNF-alfa-hemmere eller andre biologiske legemidler hos menn ved befruktningstidspunktet er assosiert med negative svangerskapsutfall (3, 13). Biologisk behandling bør derfor fortsettes hos menn som ønsker å bli far (3).
Amming
Dokumentasjon på overgang av biologiske legemidler til morsmelk er generelt begrenset. Immunglobuliner skilles ut i morsmelk, i vesentlig grad de første dagene etter fødselen (9b). Det er imidlertid primært IgA som gjenfinnes i brystmelk, mens IgG er vist å ha svært lav overgang til morsmelk (2). Molekylvekten til biologiske legemidler er også generelt svært høy, noe som predikerer lav overgang til brystmelk. Biologiske legemidler har minimal peroral biotilgjengelighet, og vil brytes ned i barnets mage/tarm-system (14-16). Samlet sett gjør dette at vi vurderer det som usannsynlig at biologiske legemidler kan gi noen systemisk påvirkning av barnet ved amming.
En kilde oppgir at det ikke bør oppfordres til å avslutte amming hvis det er nødvendig å behandle mor med biologiske legemidler, selv om det ikke foreligger erfaring med amming for den aktuelle substansen (1).
Det har ikke blitt sett forsinket utvikling eller økt infeksjonstendens hos barn som har blitt ammet av mødre som har brukt biologisk behandling (17, 18), men det foreligger ikke nok dokumentasjon til å helt utelukke slike effekter hos diebarnet.
TNF-alfa-hemmere
For både infliksimab, adalimumab og certolizumab foreligger målinger av legemiddel i morsmelk fra noen titalls ammende kvinner. Det finnes også enkelte målinger for etanercept. For alle disse legemidlene er det funnet svært lave eller ikke detekterbare mengder i morsmelk. Det er også gjennomført enkelte analyser hos barn som ammes, uten at det har blitt påvist detekterbare mengder infliksimab, adalimumab, certolizumab eller etanercept hos barnet. Det er heller ikke rapportert tilfeller av bivirkninger eller andre uheldige effekter hos barn som ammes knyttet til mors bruk av TNF-alfa-hemmere (14-16).
Flere kilder vurderer at alle TNF-alfa-hemmere kan brukes ved amming, med bakgrunn i den store molekylstørrelsen, lav overgang i morsmelk, lav peroral biotilgjengelighet samt nedbrytning av legemidlet i barnets fordøyelseskanal (1, 3, 14).
Interleukin-hemmere
For interleukin-hemmerne er anbefalingene motstridende når det gjelder amming. Flere kilder er tilbakeholdne på grunn av manglende klinisk erfaring (1, 3, 9b, 16).
En kilde oppgir at de vurderer at det ikke er grunnlag for å avslutte amming ved behov for behandling med anakinra, tocilizumab eller ustekinumab. For disse legemidlene foreligger det noe erfaring som tilsier lav overgang i morsmelk og/eller tilfeller av amming uten negative effekter hos diebarnet. Det anbefales imidlertid tilbakeholdenhet med hensyn til bruk av brodalumab, canakinumab, iksekizumab og sekukinumab, spesielt ved amming av prematurt eller nyfødt barn, da det ikke foreligger erfaring med amming (14).
Øvrige biologiske legemidler
For abatacept, belimumab og vedolizumab er kildene tilbakeholdne når det gjelder amming, på grunn av manglende klinisk erfaring (1, 3, 14, 16).
De fleste kilder er tilbakeholdne når det gjelder amming også hos kvinner som behandles med rituksimab (1, 3, 16). Det foreligger likevel noe dokumentasjon som tilsier at rituksimab har lav overgang i morsmelk, og en kilde oppgir at de vurderer at det ikke er grunnlag for å avslutte amming ved behov for slik behandling (14).
KONKLUSJON
Det er ikke holdepunkter for fosterskadelig risiko av TNF-alfa-hemmere, men eventuelle effekter på utviklingen av barnets immunsystem er foreløpig ukjent. Certolizumab er nå godkjent for bruk under graviditet og amming. For interleukin-hemmere og øvrige biologiske legemidler er det manglende klinisk erfaring for bruk under graviditet, noe som tilsier at en bør være tilbakeholden.
Et svært begrenset erfaringsgrunnlag har ikke gitt holdepunkter for at eksponering for biologiske legemidler hos menn ved befruktningstidspunktet er assosiert med negative svangerskapsutfall.
Bruk av TNF-alfa-hemmere regnes i flere kilder å være kompatible med amming, med utgangspunkt i at de har lav overgang til morsmelk, lav peroral biotilgjengelighet samt lavt opptak i barnets tarm. Disse generelle prinsippene forventes å gjelde også for interleukin-hemmere og øvrige biologiske legemidler, men manglende klinisk erfaring med bruk ved amming tilsier at man bør være tilbakeholden.
HOVEDBUDSKAP
Utredningen er utarbeidet på grunnlag av tilgjengelig litteratur og ressurser på publiseringstidspunktet. Innholdet i utredningen oppdateres ikke etter publisering. Helsepersonell er selv ansvarlig for bruk av utredningens innhold i rådgivning eller pasientbehandling.